骨格筋におけるRyR1関連筋疾患の発症機構の解明と創薬
1型リアノジン受容体(RyR1)は骨格筋筋小胞体のCa2+遊離チャネルで、興奮収縮連関に重要な役割を果たしています。RyR1は総分子量が2 MDaを超える巨大な膜タンパク質で、その遺伝子異常は悪性高熱症や種々のミオパチーを引き起こします。わたしたちは細胞内Ca2+イメージング法をはじめとした機能解析により、Ca2+動態異常が筋疾患を引き起こすメカニズムおよび治療法を検討しています。
A. 骨格筋における1型リアノジン受容体(RyR1)によるCa2+誘発性Ca2+遊離(CICR)の役割
骨格筋では筋小胞体(SR)のCa2+遊離チャネルであるRyR1が開口して筋収縮に必要なCa2+を遊離します。RyR1はSR膜上に2列に配列し、一つおきにT管膜のジヒドロピリジン受容体(DHPR)と相互作用しています(図1A)。RyR1は2つのモードで開口します。DHPRと相互作用したRyR1が脱分極により開口する脱分極誘発性Ca2+遊離(DICR)とCa2+が直接結合して開口するCa2+誘発性Ca2+遊離(CICR)です(図1B)。生理的な筋収縮ではRyR1はDICRで開口しますが、この際、「DHPRと相互作用していないRyR1がCICRによって開口してCa2+シグナルの増幅を起こす」可能性が議論されていました(図1A右、クエスチョンマーク)。
そこで、RyR1のCa2+結合部位に存在するグルタミン酸(E3896)をアラニンに置換した変異マウス(RyR1-E3896A)を作出しました。RyR1-E3896AマウスではDICRは正常に起こりますが、Ca2+が結合できないためにCICRは抑制されています(図1C)。このマウスのCa2+トランジエントおよび筋収縮は野生型マウスと同等でした。したがって、CICRがDICRの増幅機構として機能するという仮説は否定されました(図1D左)。
RyR1は悪性高熱症(Malignant Hyperthermia, MH)への関与が示唆されています。MHは吸入麻酔薬により筋強直と高体温を引き起こす筋疾患で、その主な原因はRyR1遺伝子の変異によるチャネル活性の異常亢進です。RyR1-E3896Aマウスを悪性高熱症モデルマウス(RyR1-R2509C)と交配して得た仔マウスはMHに対する抵抗性を示しました。したがって、CICRの悪性高熱症への関与が明確になりました(図1D右)。
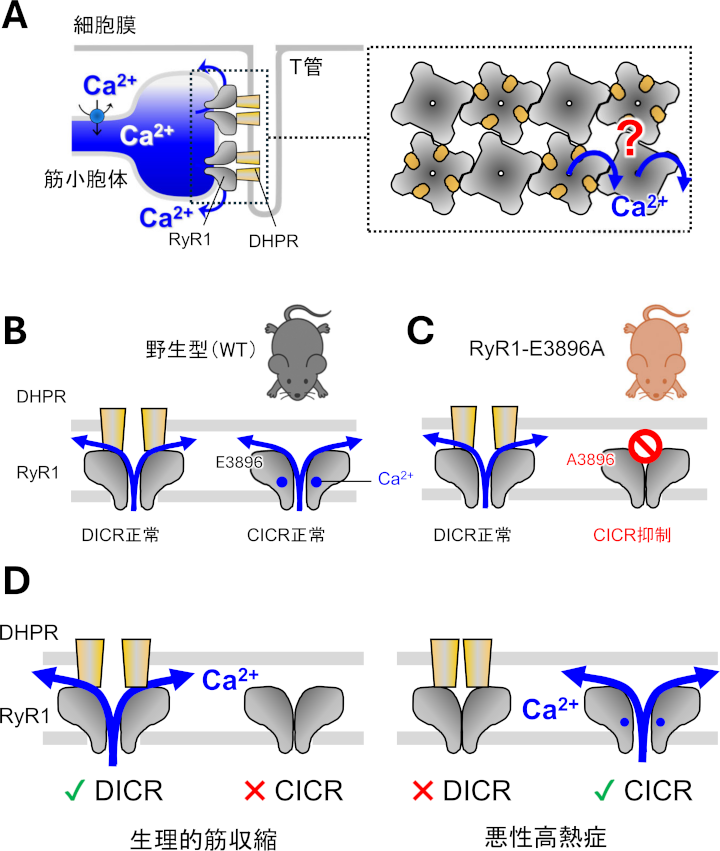 |
| 図1. A. 骨格筋におけるSRからのCa2+遊離機構。RyR1はSR膜上に2列に配列し、一つおきにT管膜のDHPRと相互作用する。B. RyR1はDICRとCICRの2種類の開口モードを有する。C. RyR1-E3896AマウスではDICRは正常に起こるが、CICRは抑制されている。D. 本研究の成果。CICRは生理的な筋収縮への寄与がほとんどないのに対して、悪性高熱症の発症に関与する。 |
参考文献
- Kobayashi T, Yamazawa T, Kurebayashi N, Konishi M, Tanihata J, Sugihara M, Miki Y, Noguchi S, Inoue YU, Inoue T, Sakuraia T, Murayama T. RyR1-mediated Ca2+-induced Ca2+ release plays a negligible role in excitation-contraction coupling of normal skeletal muscle. Proc Nat Acad Sci. 122: e2500449122, 2025[Link]
B. 1型リアノジン受容体に対する阻害薬探索と治療薬開発
悪性高熱症(MH)はRyR1チャネル活性が亢進することで発症するため、RyR1阻害薬は治療薬の有力な候補となります。現在、ダントロレンがMH治療薬として使用されていますが、水溶性が低く、血中半減期が長いという欠点があります。したがって、より良い治療薬が求められています。 私たちは変異型RyR1をHEK293細胞に発現させるとCa2+リークを起こして小胞体内Ca2+濃度が低下する現象(図1E)から着想を得て、小胞体内Ca2+濃度測定を利用したRyR1阻害薬探索システムを開発しました。機能既知化合物ライブラリのスクリーニングにより、オキソリン酸を含む4種類のRyR1阻害薬を同定しました(図2)。
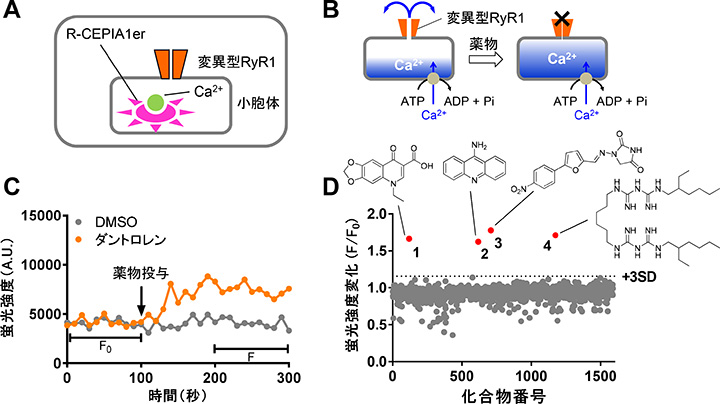 |
| 図2. A. スクリーニングに用いた細胞。HEK293細胞に変異型RyR1と小胞体内Ca2+インジケータであるR-CEPIA1erを安定発現した。B. スクリーニングのコンセプト。変異型RyR1を発現するとCa2+リークにより小胞体内Ca2+濃度が低下する。RyR1阻害薬はCa2+リークを止め、小胞体内Ca2+濃度が上昇する。C. コントロール薬物を用いた測定例。RyR1阻害薬のダントロレンは小胞体内Ca2+濃度を上昇させた。D.化合物ライブラリを用いたスクリーニング結果。4種類の化合物がヒットした。1: オキソリン酸、2: アミノアクリジン、3: ダントロレン、4: アレキシジン。 |
オキソリン酸を構造展開したところ、親和性が非常に高いCompound 1(Cpd1)を見出すことに成功しました。Cpd1は悪性高熱症モデルマウスに対して優れた治療効果を示しました(図3)。Cpd1はダントロレンに比べて生理食塩水への溶解度が高く、血中半減期が短いことからダントロレンの欠点を克服した新しい悪性高熱症治療薬になる可能性があります。
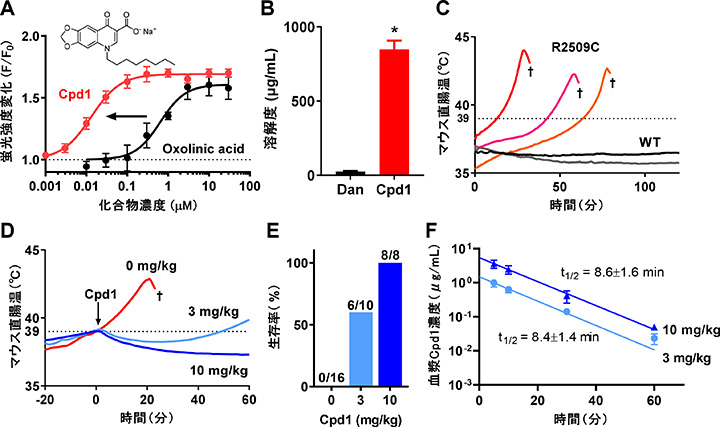 |
| 図3. A. Cpd1(オキソリン酸誘導体)はオキソリン酸に比べてRyR1阻害活性が70倍近く上昇した。B. Cpd1はダントロレンに比べて生食への溶解度が30倍以上高かった。C. 悪性高熱症モデルマウス(RyR1-R2509C)はイソフルラン麻酔により体温が上昇して死亡する。D, E. Cpd1は体温上昇を抑制し、生存率を上昇した。F. Cpd1の血中半減期は10分以内と非常に短かった。 |
参考文献
- Murayama, T, Kurebayashi N, Ikegami-Yuasa M, Mori S, Suzuki Y, Akima R, Ogawa H, Suzuki J, Kanemaru K, Oyamada H, Kiuchi Y, Iino M, Kagechika H, Sakurai T: Efficient high-throughput screening by ER Ca2+ measurement to identify inhibitors of ryanodine receptor Ca2+-release channels. Mol Pharmacol, 94: 722-730, 2018.[Link]
- Murayama T, Kurebayashi N. Assays for modulators of ryanodine receptor (RyR)/Ca2+ release channel activity for drug discovery for skeletal muscle and heart diseases. Curr Protoc Pharmacol, 87: e71, 2019. [Link]
- Mori S, Iinuma H, Manaka N, Ishigami-Yuasa M, Murayama T, Nishijima Y, Sakurai A, Arai R, Kurebayashi N, Sakurai T, and Kagechika H. Structural development of a type-1 ryanodine receptor (RyR1) Ca2+-release channel inhibitor guided by endoplasmic reticulum Ca2+ assay. Eur J Med Chem, 179: 837-848, 2019.[Link]
- Yamazawa T, Kobayashi T, Kurebayashi N, Konishi M, Noguchi S, Inoue T, Inoue YU, Nishino I, Mori S, Iinuma H, Manaka M, Kagechika H, Uryash A, Adams J, Lopez JR, Liu X, Diggle C, Allen PD, Kakizawa S, Ikeda K, Lin B, Ikemi Y, Nunomura K, Nakagawa S, Sakurai T, Murayama T. A novel RyR1-selective inhibitor prevents and rescues sudden death in mouse models of malignant hyperthermia and heat stroke. Nat Commun, 12: 4293, 2021[Link]
- Ishida R, Mori S, Murayama T, Nakamichi A, Chai X, Kurebayashi N, Iinuma H, Kagechika H. Development of a water-soluble ryanodine receptor 1 inhibitor. Bioorg Med Chem, 74, 117027. リンク:https://doi.org/10.1016/j.bmc.2022.117027[Link]
C. 骨格筋脱分極誘発性Ca2+遊離(DICR)再現系の構築
骨格筋ではRyR1は横行小管(T管)膜のジヒドロピリジン受容体(DHPR)のCav1.1サブユニットと相互作用することで、筋細胞膜の脱分極により非常に速いCa2+遊離を起こします(脱分極誘発性Ca2+遊離、DICR)(図4A)。DICRの構造基盤はCav1.1とRyR1が他のDICR構成因子(β1a、Stac3、JP2)と共に形成するDICR複合体です(図4B)。これらの構成因子の遺伝子変異は先天性ミオパチーや悪性高熱症等の難治性の筋疾患の原因となりますが、変異による疾患発症機構はよく分かっておらず治療薬も存在しません。私たちは、非筋細胞にDICR複合体を再構成することで効率的なDICR再現系の開発を目指しました。
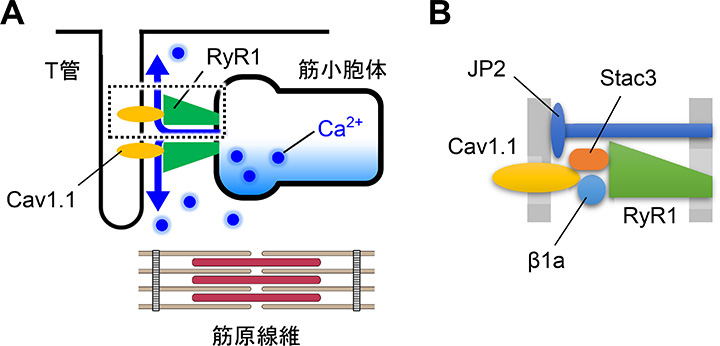 |
| 図4. 骨格筋の興奮収縮連関機構の模式図。A. T管膜のCav1.1の活性化が筋小胞体膜のRyR1チャネルを開口して収縮に必要なCa2+が遊離される。B. DICR複合体の拡大図。Cav1.1とRyR1はβ1a、Stac3、JP2等とDICR複合体を形成している。 |
RyR1と蛍光小胞体内Ca2+インジケータのR-CEPIA1er発現細胞を用いて、DICR構成因子を改変バキュロウイルスベクターにより遺伝子導入を行いました。これにより、ほとんど全ての細胞にDICR構成因子を導入することに成功しました。遺伝子導入細胞に対して高カリウム溶液で刺激してDICRを起こすと、Ca2+遊離により小胞体内Ca2+が減少し、赤色のR-CEPIA1er蛍光が低下します(図5A,B)。構成因子を導入した細胞ではカリウム濃度に依存してR-CEPIA1er蛍光が低下したのに対して、導入しなかった細胞では全く変化しませんでした(図5C)。以上の結果から、HEK293細胞においてDICRを再現できたことが分かりました。
この再現系を用いて疾患変異の評価や薬物スクリーニングに利用できるかどうかを、既報の疾患変異体と薬物を用いて調べました。先天性ミオパチーの原因となるCav1.1変異体(P742Q)ではカリウム濃度依存性が大きく低下して、DICRが抑制されていました(図5D)。また、単収縮促進薬の過塩素酸(ClO4-)はDICRを促進しました(図5E)。以上の結果は既報とよく一致しており、本再現系が疾患変異体の評価や薬物スクリーニングに利用できることを示しています。
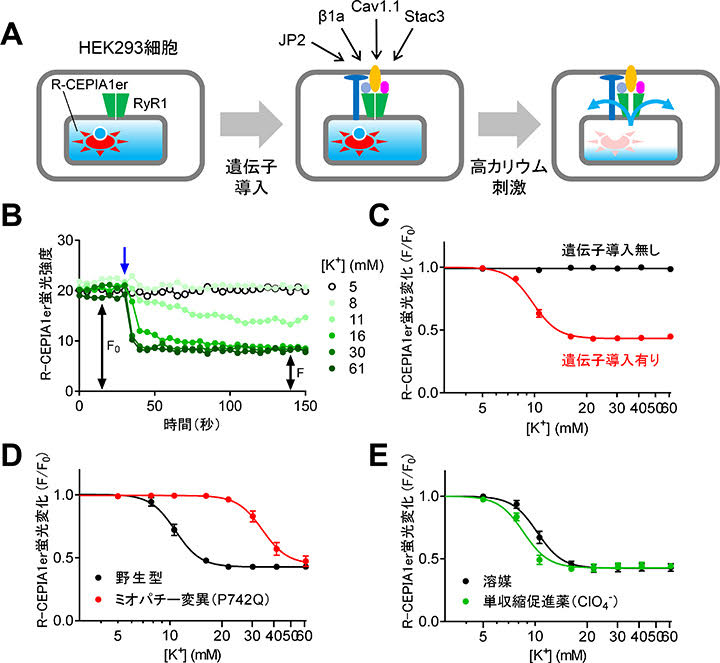 |
| 図5. DICR再現系の構築と検証。A. 左:RyR1とR-CEPIA1er(蛍光小胞体Ca2+インジケータ)を発現するHEK293細胞にDICR構成因子(Cav1.1、β1a、Stac3、JP2)を改変バキュロウイルスで遺伝子導入した。右:高カリウム溶液によりDICRが起こると小胞体内Ca2+が減少し、R-CEPIA1er蛍光が低下する。B. DICRの測定例。高カリウム溶液の添加(矢印)により蛍光が低下した。C. R-CEPIA1er蛍光のカリウム濃度依存性。遺伝子導入した細胞のみでカリウム濃度依存的な蛍光の低下が見られた。D.ミオパチー変異(Cav1.1-P742Q)の効果。カリウムの濃度依存性が右方移動し、DICRが抑制された。E. 単収縮促進薬(ClO4-)の効果。DICRが促進された。 |
参考文献
- Murayama T, Kurebayashi N, Numaga-Tomita T, Kobayashi T, Okazaki S, Yamashiro K, Nakada T, Mori S, Ishida R, Kagechika H, Yamada M, Sakurai T. A reconstituted depolarization-induced Ca2+ release platform for validation of skeletal muscle disease mutations and drug discovery. J Gen Physiol, in press..[Link]
D. 悪性高熱症および運動誘発性熱中症を引き起こす新規原因遺伝子の探索
悪性高熱症を引き起こす原因遺伝子として、これまでRYR1、CACNA1S、STAC3が知られていましたが、約3割の患者さんは遺伝子解析をしても上述の遺伝子に既知変異がみつかりません。上記の3遺伝子以外にも悪性高熱症に関わる遺伝子があると考えられます。そこで私たちは、原因遺伝子が同定されていない悪性高熱症の患者さん160名のDNAを用いて網羅的遺伝子解析を行い、ASPH遺伝子(転写産物: junctin)変異が悪性高熱症に関わることをつきとめました。
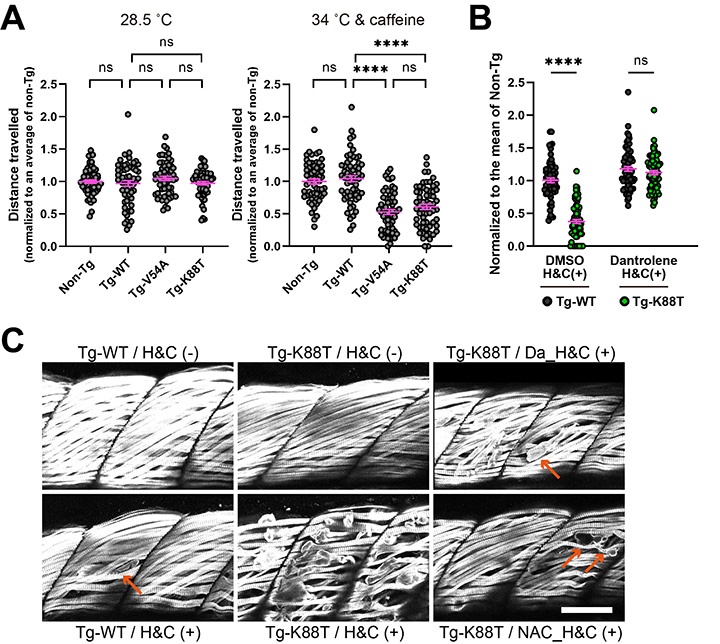 |
| 図6. Junctin変異が個体に与える影響の検証。A. ヒトの野生型junctinと変異junctinを過剰発現させたゼブラフィッシュを作成した(野生型: Tg-WT, 変異型: Tg-V54A, Tg-K88T)。通常の飼育温度(28.5 ℃)ではNon-transgenic (Non-Tg)、Tg-WT、Tg-V54A、Tg-K88Tにおいて運動能力・筋力の差は認めなかった。ゼブラフィッシュをカフェイン入り34℃飼育水で1時間飼育した後、翌日に運動能力を測定したところ、両変異型はNon-Tg、Tg-WTに比べて著明に運動能力の低下を認めた。B. 悪性高熱症治療薬であるRyR1阻害剤ダントロレンをあらかじめ予防投与したところ、Tg-K88Tゼブラフィッシュをカフェイン入り34℃環境(H&C (+))で飼育しても翌日の運動能力に低下を認めなかった。C. カフェイン入り34℃環境(H&C (+))に伴う筋組織学的変化を観察した。Tg-K88Tゼブラフィッシュでは著明な筋損傷を認めた。ダントロレン(Da)もしくは抗酸化物質N-アセチル-L-システイン(NAC)を予防投与したTg-K88Tゼブラフィッシュでは、筋損傷の程度が軽減した。 |
興味深いことに、私たちが報告したASPH遺伝子変異を持つ悪性高熱症の患者さんは、運動によって悪化する日常的な筋痙攣や、運動中の急激な体温上昇および意識障害という、運動誘発性熱中症の症状も併発していました。このことから、ASPH遺伝子異常は運動誘発性熱中症の原因にもなること、悪性高熱症と運動誘発性熱中症のメカニズムに共通点があることが示唆されました。
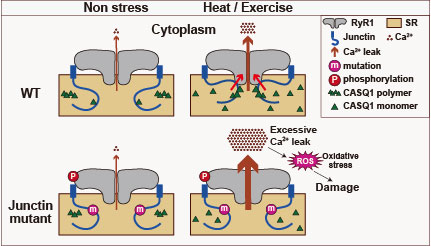 |
| 図7. Junctin変異による悪性高熱症/運動誘発性熱中症のメカニズムの提唱。安静状態(Non stress)でのRyR1を介したCa2+リークは野生型、変異型ともに少量である。高温環境下で運動すると(Heat/Exercise)、RyR1を介したCa2+リークが増えるが、野生型junctinはcalcequestrin(CASQ1)と協同してRyR1に働きかけ、Ca2+がリークしすぎないように調整する。変異型junctinはCASQ1と連携できないためRyR1を制御しきれず、増加しすぎたCa2+リークが筋損傷を引き起こすと考えられる。 |
参考文献
- Endo Y, Groom L, Celik A, Kraeva N, Lee CS, Jung SY, Gardner L, Shaw MA, Hamilton SL, Hopkins PM, Dirksen RT, Riazi S, Dowling JJ. Variants in ASPH cause exertional heat illness and are associated with malignant hyperthermia susceptibility. Nat Commun, 13: 3403, 2022. PMID: 35697689. [Link]